Penentuan Persamaan Laju Reaksi
2024/04/29
4 Komentar
Jejaring Kimia - pada materi kimia kali ini akan dibahas beberapa cara untuk menentukan persamaan laju reaksi. Ada beberapa metode yang dapat digunakan untuk menentukan persamaan laju reaksi. Metode yang digunakan dalam penentuan persamaan laju reaksi adalah metode laju awal, metode terisolasi, dan metode laju terintergrasi.
Metode penentuan persamaan laju reaksi dengan metode terisolasi yaitu semua konsentrasi dari pereaksi dibuat berlebih kecuali untuk satu jenis pereaksi. Sebagai contoh pada reaksi berikut:
Jika pereaksi A dibuat berlebih, maka konsentrasi A selama percobaan dapat dianggap konstan. Dari sini, kita dapat menentukan laju reaksi dari B yaitu vB. Dengan cara yang sama, jika konsentrasi B dibuat berlebih, maka kita dapat menentukan laju reaksi dari A yaitu vA, sehingga laju reaksi keseluruhan untuk reaksi ini adalah:
Metode penentuan persamaan laju reaksi dengan metode laju terintegrasi banyak digunakan untuk reaksi kompleks di mana persamaan laju reaksinya melibatkan zat-zat pereaksi dan produk reaksi. Di dalam metode laju terintegrasi, terdapat beberapa bentuk persamaan laju yang baku untuk setiap orde reaksi. Selanjutnya kita mencoba mencocokkan data hasil percobaan dengan persamaan laju yang baku tersebut.
Untuk mengetahui lebih lanjut tentang metode laju awal dalam penentuan persamaan laju reaksi, simak contoh reaksi antara nitrogen oksida NO dengan klorin Cl2 berikut:
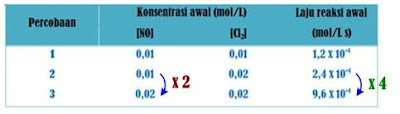
Terhadap reaksi di atas, dilakukan pengukuran untuk 3 set konsentrasi NO dan Cl2 yang berbeda seperti pada tabel berikut:
Beberapa hal yang harus dipahami terlebih dahulu sebelum menentukan persamaan laju reaksi adalah sebagai berikut:
Dari percobaan 1 dan 2, ketika [Cl2] dibuat 2x lipat ([NO] dibuat tetap), laju reaksinya menjadi 2x lipat dari sebelumnya.
Perhatikan juga percobaan 2 dan 3, ketika [NO] dibuat 2x lipat ([Cl2] dibuat tetap), laju reaksi menjadi 4x lipat dari sebelumnya. Artinya laju reaksi berbanding lurus dengan konsentrasi pereaksi dan/ orde reaksi.
Untuk menentukan persamaan laju reaksi, ikuti prosedur berikut:
1. Buat persamaan reaksinya : v = k [A]x [B]y
2. Tentukan orde masing-masing pereaksi
Untuk menentukan orde pereaksi A yaitu x, lihat 2 percobaan yang nilai [B] tetap
Untuk menentukan orde pereaksi B yaitu y, lihat 2 percobaan yang nilai [A] tetap
3. Masukkan nilai orde yang telah diperoleh ke dalam persamaan reaksi di atas.
Secara matematis, penentuan persamaan laju untuk data di atas adalah sebagai berikut:
1. Persamaan laju reaksi :
V = k [NO]x [Cl2]y
2. Orde reaksi
Orde pereaksi NO, x . . . ? (percobaan 2 dan 3)
Orde pereaksi Cl2, y . . . ? (percobaan 1 dan 2)
3. Berdasarkan nilai orde masing-masing pereaksi di atas, maka diperoleh persamaan laju reaksi :
Orde pereaksi NO, x . . . ? (percobaan 2 dan 3)
Jadi persamaan reaksinya adalah sebagai berikut:
Metode penentuan persamaan laju reaksi
Metode penentuan persamaan laju reaksi dengan laju awal yaitu dengan melibatkan pengukuran laju reaksi pada awal reaksi untuk beberapa konsentrasi awal zat-zat pereaksi.Metode penentuan persamaan laju reaksi dengan metode terisolasi yaitu semua konsentrasi dari pereaksi dibuat berlebih kecuali untuk satu jenis pereaksi. Sebagai contoh pada reaksi berikut:
A + B --> Produk reaksi
v = vA x vB
Metode penentuan persamaan laju reaksi dengan metode laju terintegrasi banyak digunakan untuk reaksi kompleks di mana persamaan laju reaksinya melibatkan zat-zat pereaksi dan produk reaksi. Di dalam metode laju terintegrasi, terdapat beberapa bentuk persamaan laju yang baku untuk setiap orde reaksi. Selanjutnya kita mencoba mencocokkan data hasil percobaan dengan persamaan laju yang baku tersebut.
Baca juga, Teori kondisi transisi
Metode laju awal dalam penentuan persamaan laju reaksi
pada materi kimia tentang penentuan persamaan laju reaksi kali ini hanya akan membahas metode laju awal yang umum diajarkan ditingkat Sekolah Menengah Atas SMA.Untuk mengetahui lebih lanjut tentang metode laju awal dalam penentuan persamaan laju reaksi, simak contoh reaksi antara nitrogen oksida NO dengan klorin Cl2 berikut:
2NO(g) + Cl2(g) --> 2NOCl(g)
Terhadap reaksi di atas, dilakukan pengukuran untuk 3 set konsentrasi NO dan Cl2 yang berbeda seperti pada tabel berikut:
Tabel hasil eksperimen laju reaksi NO dengan Cl2 (T = 27oC)
Beberapa hal yang harus dipahami terlebih dahulu sebelum menentukan persamaan laju reaksi adalah sebagai berikut:
- Tetapan laju reaksi (k) bergantung pada jenis reaksi dan suhu reaksi. Satuan untuk k tergantung dari orde reaksi keseluruhan dari persamaan laju reaksi
- Orde reaksi adalah bilangan pangkat yang menyatakan besarnya pengaruh konsentrasi zat pereaksi terhadap laju reaksi.
Dari percobaan 1 dan 2, ketika [Cl2] dibuat 2x lipat ([NO] dibuat tetap), laju reaksinya menjadi 2x lipat dari sebelumnya.
Perhatikan juga percobaan 2 dan 3, ketika [NO] dibuat 2x lipat ([Cl2] dibuat tetap), laju reaksi menjadi 4x lipat dari sebelumnya. Artinya laju reaksi berbanding lurus dengan konsentrasi pereaksi dan/ orde reaksi.
Untuk menentukan persamaan laju reaksi, ikuti prosedur berikut:
A + B --> Produk reaksi
1. Buat persamaan reaksinya : v = k [A]x [B]y
2. Tentukan orde masing-masing pereaksi
Untuk menentukan orde pereaksi A yaitu x, lihat 2 percobaan yang nilai [B] tetap
Untuk menentukan orde pereaksi B yaitu y, lihat 2 percobaan yang nilai [A] tetap
3. Masukkan nilai orde yang telah diperoleh ke dalam persamaan reaksi di atas.
Secara matematis, penentuan persamaan laju untuk data di atas adalah sebagai berikut:
1. Persamaan laju reaksi :
V = k [NO]x [Cl2]y
2. Orde reaksi
Orde pereaksi NO, x . . . ? (percobaan 2 dan 3)
Orde pereaksi Cl2, y . . . ? (percobaan 1 dan 2)
3. Berdasarkan nilai orde masing-masing pereaksi di atas, maka diperoleh persamaan laju reaksi :
V = k [NO]x [Cl2]y
V = k [NO]2 [Cl2]1
V = k [NO]2 [Cl2]
Ada cara sederhana untuk menghitung orde reaksi dalam penentuan persamaan laju reaksi. Cara sederhana dalam menentukan persamaan laju reaksi adalah sebagai berikut:V = k [NO]2 [Cl2]1
V = k [NO]2 [Cl2]
Orde pereaksi NO, x . . . ? (percobaan 2 dan 3)
2x = 4 --> x = 2
Orde pereaksi Cl2, y . . . ? (percobaan 1 dan 2)
2y = 2 --> y = 1
Jadi persamaan reaksinya adalah sebagai berikut:
V = k [NO]2 [Cl2]
![rinosafrizal[dot]com](https://blogger.googleusercontent.com/img/a/AVvXsEhSEwWXedVs6THhXNsR1RFu5KSyY-niEgE07gFSgDOe06QLjtCGL2cWFXp-SOHgcZ2FjplOH8dyXY2ZHksMrG0Y5gYC8Kheg8P70Pr_RYyU-t6j0spssBZNcq3MdjyJKKD4sw4zr8MSDiWHVuOr9LdtzYlelMAq_wXbNS4giMuCr-1I-qk0q62aglLBKlLy=s200)







Luar biasa, Pak!. Nyata sekali bahwa matematika bukan hanya untuk matematika saja. Bayangkan jika ahli kimia tak mahir matematika. Ahli kimia bisa dipastikan "jago" matematika, tapi tidak sebaliknya...Apa betul, Pak?!
BalasHapus@IsmanPunggul: Wah Bapak, pandai sekali buat saya tersanjung. Terima kasih Pak. :D
BalasHapuspak kalau senyawanya ada tiga gimana pak ????
BalasHapuspada tiap percobaan, cari 2 pereaksi yg nilainya tetap
BalasHapus