Ikatan Kimia dan Kestabilan Atom
2013/11/26
Unsur-unsur yang ada di alam pada umumnya tidak terdapat dalam bentuk bebas. Contoh logam besi Fe terdapat dalam mineral hematite Fe2O3, magnetit Fe3O4, maupun Limonit HFeO2. Contoh lain adalah logam tembaga Cu terdapat dalam mineral kalkopirit CuFeS2, logam Cobalt Co dalam mineral cobaltit CoAsS, logam Litium dalam mineral spodumen LiAlSi2O6, dan logam natrium dalam air laut maupun NaCl.
Tidak hanya logam, non logam juga terdapat dalam bentuk mineralnya seperti:
Jika berpatokan pada kalimat pertama di atas yang menyatakan bahwa “… pada umumnya unsure tidak terdapat dalam bentuk bebas”. Kalimat ini mengindikasikan bahwa terdapat satu kelompok atau golongan unsure yang keberadaannya bebas atau stabil di alam. Stabil dalam arti tidak terdapat dalam bentuk mineral atau bersenyawa atau bereaksi dengan unsure/atom lain melainkan berdiri sendiri. Kelompok/golongan unsure apakah yang dimaksud? Golongan unsure yang dimaksud adalah golongan VIIIA atau golongan unsure gas mulia yaitu Helium, Neon, Argon, Kripton, Xenon, dan Radon. Mengapa unsure-unsur gas mulia dikatakan stabil?
Unsur dikatakan stabil jika jumlah elektron pada kulit terakhirnya (elektrom valensi) memenuhi aturan duplet (max 2 elektron pada kulit terakhir seperti konfigurasi ekektron unsur Helium) dan aturan octet (max 8 elektron pada kulit terakhir). Unsure-unsure gas mulia memenuhi kedua aturan ini. Bagaimana dengan unsure/atom lain selain golongan VIIIA? Untuk menjawab pertanyaan ini, simak beberapa konfigurasi berikut, lalu bandingkan dengan konfigurasi unsure gas mulia/golongan VIIIA.
Bagaimana dengan unsure-unsur selain gas mulia? Untuk mencapai kestabilan seperti halnya konfigurasi unsure gas mulia, unsure-unsur yang tidak stabil akan melepas dan/ menerima electron terakhir sehingga akan membentuk ion positif (jika melepas electron) dan/ ion negative (jika menerima elektron).
Besarnya muatan ion pada ion positif tergantung pada jumlah electron valensi yang dilepaskan.
Bagaimana hubungan antara ikatan kimia dengan kestabilan unsure/atom? Jelas terdapat hubungan antara ikatan kimia dengan kestabilan unsur. Unsur yang tidak stabil akan berikatan dengan unsur lain dengan cara melepas dan/ menerima electron sehingga membentuk suatu senyawa (pada materi selanjutnya akan dijelaskan pada pembahasan tentang pembentukan ikatan ion). Beberapa unsur lain juga menggunakan electron valensinya secara bersama-sama untuk membentuk ikatan kimia (pada materi selanjutnya akan dijelaskan pada pembahasan tentang pembentukan ikatan kovalen).
Tidak hanya logam, non logam juga terdapat dalam bentuk mineralnya seperti:
- belerang S dalam kelompok mineral sulfate (contoh mineral gypsum CaSO4. 2H2O)
- fosfor F dalam kelompok mineral fosfat (contoh mineral chlorapatite Ca5(PO4)3(OH,F,Cl)
- Chlorine dalam kelompok mineral halida (contoh mineral carnalite KMgCl3. 6H2O) dsb.
Baca juga, Jenis-jenis ikatan kimiaPenjelasan berikut akan menjawab pertanyaan di atas.
Baca Juga
Jika berpatokan pada kalimat pertama di atas yang menyatakan bahwa “… pada umumnya unsure tidak terdapat dalam bentuk bebas”. Kalimat ini mengindikasikan bahwa terdapat satu kelompok atau golongan unsure yang keberadaannya bebas atau stabil di alam. Stabil dalam arti tidak terdapat dalam bentuk mineral atau bersenyawa atau bereaksi dengan unsure/atom lain melainkan berdiri sendiri. Kelompok/golongan unsure apakah yang dimaksud? Golongan unsure yang dimaksud adalah golongan VIIIA atau golongan unsure gas mulia yaitu Helium, Neon, Argon, Kripton, Xenon, dan Radon. Mengapa unsure-unsur gas mulia dikatakan stabil?
Unsur dikatakan stabil jika jumlah elektron pada kulit terakhirnya (elektrom valensi) memenuhi aturan duplet (max 2 elektron pada kulit terakhir seperti konfigurasi ekektron unsur Helium) dan aturan octet (max 8 elektron pada kulit terakhir). Unsure-unsure gas mulia memenuhi kedua aturan ini. Bagaimana dengan unsure/atom lain selain golongan VIIIA? Untuk menjawab pertanyaan ini, simak beberapa konfigurasi berikut, lalu bandingkan dengan konfigurasi unsure gas mulia/golongan VIIIA.
Tabel 1. Konfigurasi unsure periode 3
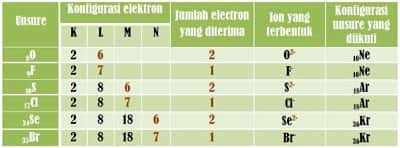
Baca juga, Memahami pembentukan ikatan ionTable 3 dan 4 berikut menggambarkan proses pembentukan ion positif dan ion negative untuk mencapai kestabilan seperti konfigurasi gas mulia.
Tabel 3. Pembentukan ion positif
Besarnya muatan ion pada ion positif tergantung pada jumlah electron valensi yang dilepaskan.
Table 4. Pembentukan ion negatif
Besarnya muatan ion pada ion negative tergantung pada jumlah electron yang diterima untuk mencapai konfigurasi electron stabil seperti halnya gas mulia.Bagaimana hubungan antara ikatan kimia dengan kestabilan unsure/atom? Jelas terdapat hubungan antara ikatan kimia dengan kestabilan unsur. Unsur yang tidak stabil akan berikatan dengan unsur lain dengan cara melepas dan/ menerima electron sehingga membentuk suatu senyawa (pada materi selanjutnya akan dijelaskan pada pembahasan tentang pembentukan ikatan ion). Beberapa unsur lain juga menggunakan electron valensinya secara bersama-sama untuk membentuk ikatan kimia (pada materi selanjutnya akan dijelaskan pada pembahasan tentang pembentukan ikatan kovalen).
Kesimpulan akhir : Usaha untuk mencapai suatu kestabilan seperti konfigurasi gas mulia mendorong suatu unsur untuk saling berikatan sehingga terbentuklah suatu senyawa yang stabil.