Menghitung Massa Atom Relatif dan Molekul Relatif
2010/03/24
Pada awal abad ke XX, para ahli kimia melakukan percobaan untuk menghitung massa satu atom. Dari percobaan diperoleh:
Massa atom relatif (Ar) menyatakan perbandingan massa rata-rata satu atom suatu unsur terhadap 1/12 massa atom C-12 atau dapat dituliskan:
 Untuk menghitung massa satu atom unsure X, maka dapat dihitung dengan rumus:
Untuk menghitung massa satu atom unsure X, maka dapat dihitung dengan rumus:
 Massa atom relatif (Ar) dapat juga dilihat langsung pada tabel sistem periodik pada masing-masing unsur. Biasanya terletak di pojok kiri atas.
Massa atom relatif (Ar) dapat juga dilihat langsung pada tabel sistem periodik pada masing-masing unsur. Biasanya terletak di pojok kiri atas.
Molekul adalah gabungan dari beberapa unsur dengan perbandingan tertentu. Unsur-unsur yang sama membentuk molekul unsur, sedangkan unsur-unsur yang berbeda membentuk molekul senyawa. Massa molekul unsur atau senyawa dinyatakan oleh massa molekul relatif (Mr). Massa molekul relatif (Mr) adalah perbandingan massa molekul unsur atau senyawa terhadap 1/12 x masssa atom C-12. Secara matematis dapat dirumuskan sebagai berikut:

 Massa molekul relatif juga dapat dihitung dengan menjumlahkan massa atom relatif (Ar) unsur-unsur penyusun molekul dengan rumus sebagai berikut:
Massa molekul relatif juga dapat dihitung dengan menjumlahkan massa atom relatif (Ar) unsur-unsur penyusun molekul dengan rumus sebagai berikut:
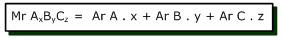 x, y, z = indeks/jumlah atom A (untuk x), B (untuk y), dan C (untuk z)
x, y, z = indeks/jumlah atom A (untuk x), B (untuk y), dan C (untuk z)
Ar = massa atom relatif masing-masing unsur (dapat dilihat pada tabel sistem periodik)
- Massa satu atom H : 1.66 x 10-24 gram
- Massa satu atom O : 2.70 x 10-23 gram
- Massa satu atom C : 1.99 x 10-23 gram
Massa atom relatif (Ar) menyatakan perbandingan massa rata-rata satu atom suatu unsur terhadap 1/12 massa atom C-12 atau dapat dituliskan:
 Untuk menghitung massa satu atom unsure X, maka dapat dihitung dengan rumus:
Untuk menghitung massa satu atom unsure X, maka dapat dihitung dengan rumus: Massa atom relatif (Ar) dapat juga dilihat langsung pada tabel sistem periodik pada masing-masing unsur. Biasanya terletak di pojok kiri atas.
Massa atom relatif (Ar) dapat juga dilihat langsung pada tabel sistem periodik pada masing-masing unsur. Biasanya terletak di pojok kiri atas.Baca Juga

 Massa molekul relatif juga dapat dihitung dengan menjumlahkan massa atom relatif (Ar) unsur-unsur penyusun molekul dengan rumus sebagai berikut:
Massa molekul relatif juga dapat dihitung dengan menjumlahkan massa atom relatif (Ar) unsur-unsur penyusun molekul dengan rumus sebagai berikut: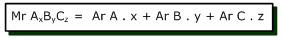 x, y, z = indeks/jumlah atom A (untuk x), B (untuk y), dan C (untuk z)
x, y, z = indeks/jumlah atom A (untuk x), B (untuk y), dan C (untuk z)Ar = massa atom relatif masing-masing unsur (dapat dilihat pada tabel sistem periodik)
![rinosafrizal[dot]com](https://blogger.googleusercontent.com/img/a/AVvXsEhSEwWXedVs6THhXNsR1RFu5KSyY-niEgE07gFSgDOe06QLjtCGL2cWFXp-SOHgcZ2FjplOH8dyXY2ZHksMrG0Y5gYC8Kheg8P70Pr_RYyU-t6j0spssBZNcq3MdjyJKKD4sw4zr8MSDiWHVuOr9LdtzYlelMAq_wXbNS4giMuCr-1I-qk0q62aglLBKlLy=s200)
